Rationale
Zum Zeitpunkt des operativen Eingriffs leiden 11 – 48% der chirurgischen Patienten an einer Blutarmut (1). Nach Definition der WHO entspricht dies bei Frauen einem Hämoglobin (Hb)-Wert <12 g/dl und bei Männern einem Hb-Wert <13 g/dl. Bleibt die präoperative Anämie unbehandelt, hat dies einen dramatischen Einfluss auf das klinische Outcome der Patienten. Tatsächlich ist die Anämie ein unabhängiger Risikofaktor für eine erhöhte Morbidität und Sterblichkeit sowie einen längeren Krankenhausaufenthalt (2-7). Darüber hinaus ist die präoperative Anämie eine der Hauptprädiktoren für die Transfusion allogener Erythrozytenkonzentrate (EK) (8).
Bei adäquater Indikationsstellung, beispielsweise im Zusammenhang mit massiven Blutverlusten nach Polytrauma, ist der Einsatz von EK zur Lebensrettung eine wichtige Maßnahme. Nichtsdestotrotz muss immer bedacht werden, dass EK, wie jedes andere Medikament auch, nicht frei von Nebenwirkungen sind (9). Mögliche Komplikationen sind u.a. die transfusionsassoziierte Volumenüberladung, Hypothermie, Hyperkaliämie, Hypocalciämie, Transfusionshämosiderose, allergische Transfusionsreaktion, hämolytische Transfusionsreaktion, (febrile) nicht-hämolytische Transfusionsreaktion, transfusionsassoziierte akute Lungeninsuffizienz, transfusionsassoziierte Graft-versus-Host-Erkrankung. Zusätzlich berichten retrospektive Studien von einer möglichen Assoziation zwischen einer höheren Anzahl an Bluttransfusionen und einer erhöhten Morbidität. Anhand einzelner Studien könnte selbst die Transfusion einer einzelnen Blutkonserve die Wahrscheinlichkeit eines Herz- und/ oder ischämischen Schlaganfalles erhöhen und mit einem längeren Krankenhausaufenthalt im Zusammenhang stehen (10). Ein möglicher Zusammenhang zwischen Bluttransfusionen und einem erhöhten Risiko für Tumorrezidive wird aktuell ebenso diskutiert (11, 12). Auch kann trotz maßgeblich verbesserter Prozessabläufe eine Fehltransfusion oder auch eine Übertragung von (bisher unbekannten) Viren und Erregern nicht gänzlich ausgeschlossen werden.
Neben der präoperativen Anämie erhöhen natürlich auch unnötige Blutverluste die Wahrscheinlichkeit für Bluttransfusion und die assoziierten Risiken. Zu den Hauptursachen zählen u.a. größere intraoperative Blutverluste, Koagulopathie, iatrogene Blutverluste, etc.
Aufgrund der aufgeführten Risiken muss auch die vorherrschende Transfusionspraxis kritisch hinterfragt werden. Aktuelle Studien zeigen, dass es hier national, selbst bei Patienten mit vergleichbarem Risikoprofil, deutliche Unterschiede in Abhängigkeit der behandelnden Klinik geben kann (8). Dies ist verwunderlich, gibt es doch, zumindest in Deutschland, definitive Vorgaben zur korrekten Indikationsstellung von allogenen Blutprodukten (13). Auch internationale Daten zeigen massive Abweichungen, wobei Deutschland mit 54,6 EK pro 1000 Einwohnern (zum Vergleich: England 35,3 EK pro 1000 Einwohnern) noch immer den „Spitzenreiter“ gibt (14). Zusätzlich sollte die Tatsache, dass aufgrund des demographischen Wandels im Zuge dessen zukünftig immer mehr Bedürftige immer weniger Spendern gegenüberstehen, einem „irrationalen“ Umgang mit EK unbedingt Einhalt geboten werden. Denn geschieht dies nicht, wird die äußerst wertvolle Ressource Blut bei dringender Indikation bald nicht mehr ausreichend zur Verfügung stehen.
Patient Blood Management
Patient Blood Management ist ein interdisziplinäres und patientenzentriertes medizinisches Gesamtkonzept, das den o.g. Herausforderungen entgegentritt und so eine Steigerung der Patientensicherheit fördert. Essentieller Bestandteil des Konzeptes ist es, jedem Patienten eine exakt auf dessen Bedürfnisse zugeschnittene Therapie zu ermöglichen und entsprechend nicht mehr auf den antiquierten „one-size-fits-all“-Therapieansatz zurückzugreifen. Nicht das Blutprodukt selbst steht im Mittelpunkt, sondern der Patient und die Vielzahl an PBM-Einzelmaßnahmen, die sich in den folgenden drei Säulen zusammenfassen lassen:
I Säule: Detektion und ggf. Behandlung einer präoperativen Anämie
Mit einer außerordentlich hohen Inzidenzrate stellt die präoperative Anämie bei jedem dritten chirurgischen Patienten ein erhebliches Risiko für eine perioperative Fremdbluttransfusion sowie für ein schlechteres Outcome dar. Große intraoperative Blutverluste resultieren automatisch in einer Eskalation der beiden Risikoparameter. Folglich sollte bei elektiven Eingriffen mit erwarteten Blutverlusten > 500 ml und/oder einer Transfusionswahrscheinlichkeit > 10% (z.B. Herzchirurgie, Endoprothetik-Revisionen, viszerale Tumorchirurgie oder Gefäßchirurgie) eine ggf. vorhandene Anämie unbedingt differentialdiagnostisch abgeklärt und, wenn medizinisch möglich, präoperativ korrigiert werden. Neben chronischen Erkrankungen (circa 40%; u.a. chronische Entzündungen, Tumore, Autoimmunkrankheiten oder Niereninsuffizienz), liegt die Ursache der Blutarmut bei circa einem Drittel der Patienten in einem Eisenmangel (15).
Zur Differentialdiagnostik sowie zur anschließenden Therapiesteuerung werden wenige, teils routinemäßige vorhandene Blutparameter (z.B. Transferrinsättigung, Ferritin, löslicher Transferrinrezeptor) herangezogen. Während die Therapie einer Anämie chronischer Erkrankungen präoperativ häufig nur schwer durchführbar ist, ist die Korrektur einer Eisenmangelanämie ein relativ einfaches Vorgehen. Folglich, aber auch aufgrund der hohen Inzidenzrate, liegt letztere besonders im Fokus aktueller Publikationen und Leitlinien zum präoperativen Anämiemanagement (16-19). Aufgrund der häufig knappen Vorlaufzeit zur anstehenden OP, sind orale Eisenprodukte ineffektiv, um die leeren Eisenspeicher adäquat und rechtzeitig zu substituieren, sodass parenterale Eisengaben das vorwiegende Mittel der Wahl sind. Um ein optimales Behandlungsergebnis, sprich eine maximale Steigerung des Hb-Wertes, zu erzielen, sollten aber auch bei parenteraler Eisensubstitution möglichst 2-4 Wochen zwischen Therapie und Eingriff liegen (20). Sollte der Zeitraum, etwa aus logistischen Gründen, kürzer werden, ist dies häufig trotzdem kein Grund, von einer intravenösen Eisengabe abzusehen. Tatsächlich konnte mittlerweile gezeigt werden, dass selbst die Eisengabe nur wenige Tage vor der OP oder gar erst postoperativ zu einem relevanten Hämoglobinanstieg und besseren Patientenoutcome beitragen kann (21, 22). Nichtsdestotrotz sollte aber auch der Aufschub einer elektiven Operation bis zum Zeitpunkt, zu dem der Patient optimal vorbereitet ist, eine Option darstellen und individuell mit dem Patienten und im ärztlichen Team diskutiert werden. Die Wartezeit für einen größeren chirurgischen Eingriff beträgt teilweise 4-8 Wochen, vor allem bei Nicht-Tumoreingriffen. Eine „schnelle“ EK-Transfusion während der OP, anstatt einer sinnvollen präoperativen Vorbereitung bei nachgewiesenem Eisenmangel mit/ohne Anämie wirft neben medizinischen auch ethische und juristische Fragen auf.
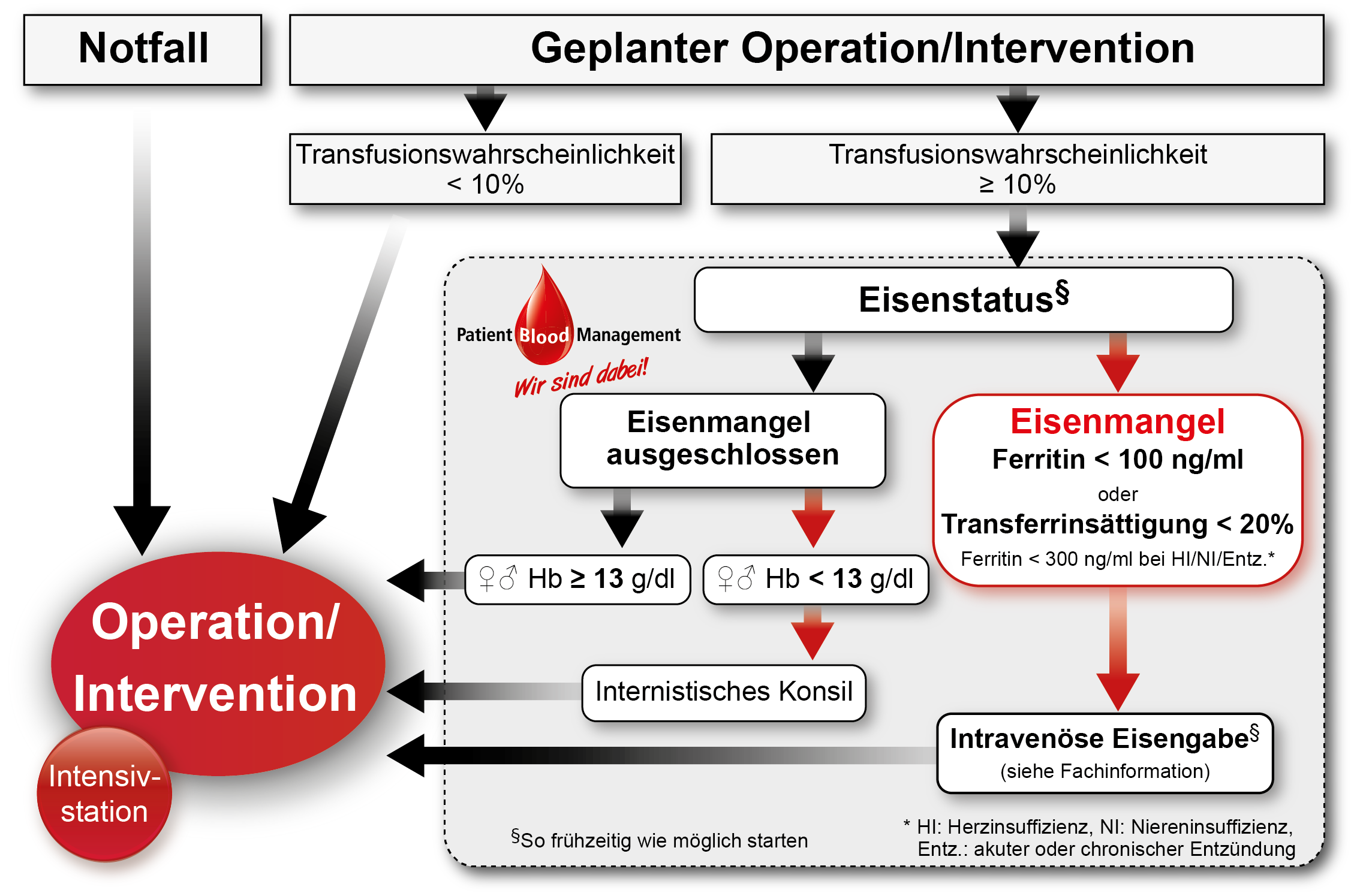
Eine spezialisierte Anämieambulanz ermöglicht es, die Aufgaben des präoperativen Anämiemanagements zu zentralisieren. Ein Besuch der Patienten in der Ambulanz könnte etwa nach dem Aufklärungsgespräch zur OP oder der Prämedikation in die klinische Routine eingeflochten werden. Klinische Fachbereiche (z.B. Chirurgie, Anästhesiologie, etc.) haben dadurch keinen Mehraufwand. In der Ambulanz lassen sich Diagnose und Therapie durch einen Algorithmus, in welchem entsprechende Schwellenwerte hinterlegt sind, maßgeblich vereinfachen (Abbildung 1).
Dieses Erklärvideo fasst den Ablauf von intravenösen Eisengaben zusammen:
II Säule: Minimierung des Blutverlustes und vermehrte Nutzung fremdblutsparender Maßnahmen
Um einer iatrogen Anämien und der damit häufig assoziierten Fremdbluttransfusion entgegenzuwirken, ist eine maximale Reduktion unnötiger Blutverluste sowie ein maximaler Einsatz fremdblutsparender Maßnahmen unabdingbar.

Im perioperativen Setting, insbesondere aber auf der Intensivstation, können Blutentnahmen zu diagnostischen Zwecken das Blutvolumen des Patienten drastisch reduzieren und zu einer im Krankenhaus-erworben Anämie führen. Folglich ist es unbedingt notwendig, Entnahmefrequenz sowie Entnahmeroutine, den individuellen Bedürfnissen des jeweiligen Patienten anzupassen. Zusätzlich sollten Blutentnahmeröhrchen mit dem kleinsten zur exakten Analyse benötigten Volumen (auch möglich: geringere Füllhöhe) genutzt werden (Abbildung 2). Ebenfalls gilt es, Verwürfe im Rahmen diagnostischer Blutentnahmen bestmöglich zu vermeiden. Hier können geschlossene Blutentnahmesysteme einen wichtigen Beitrag leisten.
Präoperativ können standardisierte Prozeduren (SOPs) die frühzeitige Identifikation möglicher Gerinnungsstörungen unterstützen und so dabei helfen intraoperativen Blutverlusten vorzubeugen. Hierbei muss unbedingt auch das periinterventionelle Management einer Antikoagulation (z.B. NOAKs, Thrombozytenaggregationshemmer, etc.) Beachtung finden. Um intraoperative Blutverluste minimal zu halten, ist der Einsatz moderner chirurgischer Techniken (z.B. minimalinvasive Methoden) essentiell. Eine weitere nicht minderwichtige Rolle spielt auch hier ein optimales Management der Gerinnung. Grundsätzlich zählt dazu eine akribische und konsequente Korrektur der physiologischen Rahmenbedingungen (z.B. Körpertemperatur, ionisiertes Kalzium, pH-Wert). Zur Überwachung, aber auch zur Steuerung einer ggf. indizierten Korrektur durch Faktorkonzentrate, sollte, wenn immer möglich, eine bettseitige, sprich am Point-of-Care durchführbare, Gerinnungsdiagnostik Anwendung finden (23). Bei Blutverlusten > 500 ml ist die maschinelle Autotransfusion – also das Auffangen, Reinigen und Wiederzuführen von Wundblut – eine wertvolle Möglichkeit, den Einsatz von allogenen Blutprodukten so gering wie möglich zu halten (24).
III Säule: Rationaler Einsatz von Erythrozytkonzentraten

Das Ziel einer Bluttransfusion ist die Sicherstellung eines suffizienten globalen Sauerstoffangebots und damit die Minimierung der Risiken einer akuten Anämie. Vor einer Transfusion sollten letztere jedoch unbedingt den Risiken eines EK gegenübergestellt und individuell entschieden werden, was letztendlich das geeignetere Vorgehen ist. Die Entscheidungsfindung darf dabei nicht alleine anhand des Hb-Werts erfolgen, sondern muss auch weitere Faktoren, wie die individuelle Anämietoleranz, der akute klinische Zustand des Patienten sowie physiologische Transfusionstrigger (z.B. Abfall der zentralvenösen O2-Sättigung <60%) beachten (13). Beispielsweise können Patienten mit normaler Herz-Kreislauf-Funktion häufig niedrigere Hb-Werte (6-8 g/dl) kompensieren. Tatsächlich konnte für den Großteil der medizinischen Settings trotz einer Vielzahl an Studien kein Vorteil einer liberalen (Ziel Hb-Wert: 9-11 g/dl) gegenüber einer restriktiveren Transfusionsstrategie (Ziel Hb-Wert: 7-9 g/dl) gezeigt werden (25-28). Bei kardiovaskulären Hoch-Risikopatienten, geriatrischen oder onkologischen Patienten ist die adäquate Transfusionsstrategie aktuell noch Gegenstand wissenschaftlicher Diskussionen (29). Generell muss beachtet werden, dass allogene Bluttransfusion immer nur das „Ultima Ratio“ einer Anämietherapie darstellen und immer mit Nebenwirkungen assoziiert sein können. Analoge oder digitale Checklisten (Abbildung 3), auf welchen die Indikation für die EK angegeben wird, sind gute Optionen um den behandelnden Arzt im Alltag bei der korrekten Entscheidung zu unterstützen (30).
Referenzen
- Munoz M, Gomez-Ramirez S, Campos A, Ruiz J, Liumbruno GM. Pre-operative anaemia: prevalence, consequences and approaches to management. Blood transfusion. 2015;13(3):370-9.
- Baron DM, Hochrieser H, Posch M, Metnitz B, Rhodes A, Moreno RP, et al. Preoperative anaemia is associated with poor clinical outcome in non-cardiac surgery patients. British Journal of Anaesthesia. 2014;113(3):416-23.
- Klein AA, Collier TJ, Brar MS, Evans C, Hallward G, Fletcher SN, et al. The incidence and importance of anaemia in patients undergoing cardiac surgery in the UK – the first Association of Cardiothoracic Anaesthetists national audit. Anaesthesia. 2016;71(6):627-35.
- Musallam KM, Tamim HM, Richards T, Spahn DR, Rosendaal FR, Habbal A, et al. Preoperative anaemia and postoperative outcomes in non-cardiac surgery: a retrospective cohort study. The Lancet. 2011;378(9800):1396-407.
- Carson JL, Duff A, Poses RM, Berlin JA, Spence RK, Trout R, et al. Effect of anaemia and cardiovascular disease on surgical mortality and morbidity. The Lancet. 1996;348(9034):1055-60.
- Leichtle SW, Mouawad NJ, Lampman R, Singal B, Cleary RK. Does preoperative anemia adversely affect colon and rectal surgery outcomes? Journal of the American College of Surgeons. 2011;212(2):187-94.
- von Heymann C, Kaufner L, Sander M, Spies C, Schmidt K, Gombotz H, et al. Does the severity of preoperative anemia or blood transfusion have a stronger impact on long-term survival after cardiac surgery? The Journal of Thoracic and Cardiovascular Surgery. 2016;152(5):1412-20.
- Gombotz H, Rehak PH, Shander A, Hofmann A. Blood use in elective surgery: the Austrian benchmark study. Transfusion. 2007;47(8):1468-80.
- Delaney M, Wendel S, Bercovitz RS, Cid J, Cohn C, Dunbar NM, et al. Transfusion reactions: prevention, diagnosis, and treatment. The Lancet. 2016;388(10061):2825-36.
- Whitlock EL, Kim H, Auerbach AD. Harms associated with single unit perioperative transfusion: retrospective population based analysis. BMJ. 2015;350:h3037.
- Acheson AG, Brookes MJ, Spahn DR. Effects of Allogeneic Red Blood Cell Transfusions on Clinical Outcomes in Patients Undergoing Colorectal Cancer Surgery: A Systematic Review and Meta-Analysis. Annals of Surgery. 2012;256(2):235-44.
- Horowitz M, Neeman E, Sharon E, Ben-Eliyahu S. Exploiting the critical perioperative period to improve long-term cancer outcomes. Nature reviews Clinical oncology. 2015;12(4):213-26.
- Vorstand der Bundesärztekammer auf Empfehlung des Wissenschaftlichen Beirats. Querschnitts-Leitlinien (BÄK) zur Therapie mit Blutkomponenten und Plasmaderivaten. 2014;4. überarbeitete Auflage.
- Carson JL, Triulzi DJ, Ness PM. Indications for and Adverse Effects of Red-Cell Transfusion. The New England journal of medicine. 2017;377(13):1261-72.
- Camaschella C. Iron-deficiency anemia. The New England journal of medicine. 2015;372(19):1832-43.
- Meybohm P, Muller MM, Zacharowski K. [Preoperative Preparation: Patient Blood Management – What is Optimal?]. Anästhesiologie, Intensivmedizin, Notfallmedizin und Schmerztherapie. 2017;52(5):326-40.
- Munoz M, Acheson AG, Auerbach M, Besser M, Habler O, Kehlet H, et al. International consensus statement on the peri-operative management of anaemia and iron deficiency. Anaesthesia. 2017;72(2):233-47.
- National Blood Association Australia. Patient Blood Management Guidelines. [Accessed: 17.08.2017]. Available from: https://www.blood.gov.au/pbm-guidelines.
- National Institute for Health and Care Excellence. Blood transfusion – Quality standard 138. 2016 [Accessed: 17.08.2017]. Available from: https://www.nice.org.uk/guidance/qs138.
- Froessler B, Palm P, Weber I, Hodyl NA, Singh R, Murphy EM. The Important Role for Intravenous Iron in Perioperative Patient Blood Management in Major Abdominal Surgery: A Randomized Controlled Trial. Annals of Surgery. 2016;264(1):41-6.
- Meybohm P, Goehring MH, Choorapoikayil S, Fischer D, Rey J, Herrmann E, et al. Feasibility and efficiency of a preoperative anaemia walk-in clinic: secondary data from a prospective observational trial. British Journal of Anaesthesia. 2017;118(4):625-6.
- Khalafallah AA, Yan C, Al-Badri R, Robinson E, Kirkby BE, Ingram E, et al. Intravenous ferric carboxymaltose versus standard care in the management of postoperative anaemia: a prospective, open-label, randomised controlled trial. The Lancet Haematology. 2016;3(9):e415-25.
- Weber CF, Gorlinger K, Meininger D, Herrmann E, Bingold T, Moritz A, et al. Point-of-care testing: a prospective, randomized clinical trial of efficacy in coagulopathic cardiac surgery patients. Anesthesiology. 2012;117(3):531-47.
- Meybohm P, Choorapoikayil S, Wessels A, Herrmann E, Zacharowski K, Spahn DR. Washed cell salvage in surgical patients: A review and meta-analysis of prospective randomized trials under PRISMA. Medicine. 2016;95(31):e4490.
- Holst LB, Petersen MW, Haase N, Perner A, Wetterslev J. Restrictive versus liberal transfusion strategy for red blood cell transfusion: systematic review of randomised trials with meta-analysis and trial sequential analysis. BMJ. 2015;350:h1354.
- Brunskill SJ, Millette SL, Shokoohi A, Pulford EC, Doree C, Murphy MF, et al. Red blood cell transfusion for people undergoing hip fracture surgery. Cochrane Database of Systematic Reviews. 2015(4):CD009699.
- Carson JL, Sieber F, Cook DR, Hoover DR, Noveck H, Chaitman BR, et al. Liberal versus restrictive blood transfusion strategy: 3-year survival and cause of death results from the FOCUS randomised controlled trial. Lancet. 2015;385(9974):1183-9.
- Carson JL, Terrin ML, Noveck H, Sanders DW, Chaitman BR, Rhoads GG, et al. Liberal or restrictive transfusion in high-risk patients after hip surgery. The New England journal of medicine. 2011;365(26):2453-62.
- Simon GI, Craswell A, Thom O, Fung YL. Outcomes of restrictive versus liberal transfusion strategies in older adults from nine randomised controlled trials: a systematic review and meta-analysis. The Lancet Haematology. 2017;4(10):e465-e74.
- Goodnough LT, Shieh L, Hadhazy E, Cheng N, Khari P, Maggio P. Improved blood utilization using real-time clinical decision support. Transfusion. 2014;54(5):1358-65.
